| Sitemap Wissensch.+Technik Astronomie+Raumfahrt Wasser Medizin Blogs HTML-Tutorial Politik+Gesellschaft Wirtschaft+Ökonomie Harz+Oberharz Skandinavien Humor+Satire Sonstiges Downloads |
Grimm, H.:
Der "Mpemba-Effekt": Gefriert heißes Wasser schneller als kaltes Wasser?http://www.wissenschaft-technik-ethik.de/wasser_mpemba-effekt.shtmlzuletzt aktualisiert am 02.03.2022 |
|
Seiteninhalt:
Weiterführende Links:
Sonstige Verweise:
1. Vorbemerkung In Internet und populärwissenschaftlicher Literatur kursieren verschiedene Beiträge zum sogenannten "Mpemba-Effekt", demzufolge heißes Wasser unter ansonsten gleichen Bedingungen rascher gefriert als eine gleiche Menge kalten Wassers. Dieses Phänomen soll bereits von Aristoteles, Bacon und Descartes beschrieben und 1963 von einem Hochschüler namens Mpemba bei der Herstellung von Speiseeis zufällig wiederentdeckt worden sein /1,2,5,6,10/. Über folgende Vorgaben ist man sich weitgehend einig: "Gleiche Mengen" Wasser in beiden Fällen Unterschiedliche Ausgangs-Wassertemperaturen Gleiche Behälter Gleiche Umgebung Gleiche Umgebungstemperatur, unter dem Gefrierpunkt des Wassers Über die weiteren Begleitumstände dagegen variieren die Vorstellungen erheblich: Wassermengen (gleiche Ausgangsmenge oder Ausgangsmenge so gewählt, dass gleiche Mengen bei Beginn der Eisbildung?) Behälter (Größe, Form, offen oder geschlossen, Unterlage etc.) Art der Umgebung (Freiland bei Frost, Gefrierfach etc.) Umgebungstemperatur Ausgangsmengen und -temperaturen der Wasserproben Versuchsziel (Bildung dünner Eisschicht oder vollständiges Gefrieren?) Während einige Autoren ausdrücklich die Auffassung vertreten, der Mpemba-Effekt trete nicht unter allen Umständen auf /1,2,5,6/, erwecken andere eher den Eindruck, er trete grundsätzlich immer auf /4,8,9/. Einzelne halten den Effekt sogar für eine besondere, exklusive Eigenschaft des Wassers /9,10/. Erwähnt wird auch eine praktische Nutzung des Mpemba-Effekts: "... the Mpemba effect is put to good use by many ice-cream makers, who use warm milk instead of cool ..." /10/. Die nachfolgende detaillierte Diskussion wird sich zwangsläufig an den sehr weit gesteckten Vorgaben orientieren müssen, um der Vielfalt der Aspekte gerecht werden zu können. Der erkennbaren Sichtweise der überwiegenden Mehrzahl der Autoren folgend, soll der Mpemba-Effekt im Folgenden als ein auch unter einer Vielzahl alltäglich auftretender Bedingungen auftretendes Phänomen, also keinesfalls als eine "Laboratoriumskuriosität", betrachtet werden. 2. Theoretische Diskussion und experimentelle Befunde 2.1 Verdunstung Einige Autoren erwähnen den mit der Wassertemperatur rapide ansteigenden Wasserverlust durch Verdunstung als mögliche Ursache für den Mpemba-Effekt /1,3,5/. Es ist leicht einzusehen, dass mit einer Verringerung der Wassermenge eine entsprechende Verringerung der zum Gefrieren benötigten Zeit einhergeht. Falls der dabei erzielte Zeitgewinn die zum Abkühlen erforderliche zusätzliche Zeit überkompensiert, kann das ursprünglich wärmere Wasser tatsächlich rascher gefroren sein. Die von einigen Autoren angegebene verdunstete Wassermenge von "bis zu ein Viertel des Wassers" /1,3/ entbehrt jedoch jeder vernünftigen Grundlage, wie nachfolgende Betrachtung zeigt: Eine Abschätzung der bei Umgebungstemperaturen unter 0°C während der Abkühlung von 100°C auf 0°C höchstens verdunstbaren Wassermenge beruht auf der Vorgabe, dass die für die Abkühlung des Wassers notwendige Abfuhr von Wärmeenergie ausschließlich durch Verdunstung erfolgt. Aus der Beziehung m(W,Anf.) * cp(W) * (100°C - 0°C) = m(W,verd.max) * DeltaHv(W,0°C) mit m(W,Anf.): Anfangsmasse des Wassers m(W,verd.max): maximal verdunstete Wassermenge DeltaHv(W,0°C): Verdampfungsenthalpie d. Wassers bei 0°C (= ca. 2500 kJ/kg) cp(W): spezifische Wärmekapazität d. Wassers (= 4,18 kJ/kg/K) beträgt die maximal verdunstete Wassermenge m(W,verd.) 16,7% der Ausgangsmenge. Bei realen Vorgängen wird der verdunstete Wasseranteil noch erheblich geringer sein, da stets ein Teil der Wärmeenergie durch Wärmeübergang an die Luft abgegeben wird und somit für eine Verdunstung nicht mehr zur Verfügung steht. Die realen Verhältnisse während eines Abkühlvorgangs an einer Wasseroberfläche bei niedriger Lufttemperatur wurden anhand eines orientierenden Versuches exemplarisch untersucht. Dazu wurde ein weithalsiger Thermosbehälter (Wärmeaustausch ausschließlich über die Wasseroberfläche möglich) bei Temperaturen um 0°C bis knapp unter den oberen Rand mit heißem Wasser gefüllt und Wassertemperatur und Verdampfungsverlust über der Zeit verfolgt. Das Ergebnis ist in Abb.1 dargestellt: 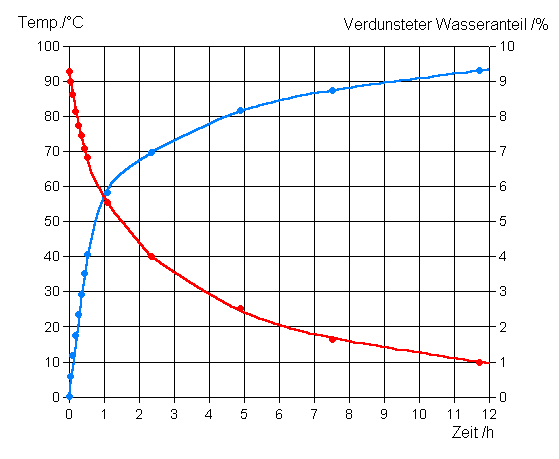
Abb.1: Zeitlicher Verlauf von Temperatur und verdunstetem Wasseranteil bei der Abkühlung von Wasser ausschließlich über die Oberfläche Das vergleichsweise heiße Wasser in der ersten Phase des Abkühlvorgangs verliert erwartungsgemäß den weitaus größten Teil seiner Wärmeenergie durch Verdunstung. Danach geht der Anteil der Verdunstung am Wärmeverlust erheblich zurück. Über die gesamte Versuchszeit bzw. die dabei durchlaufene Temperaturdifferenz beträgt der maximal mögliche Verdunstungsanteil 14,0%, tatsächlich verdunsteten jedoch lediglich 9,3% der ursprünglich vorhandenen Wassermenge. Die in Abb.1 dargestellten Verläufe erlauben hier bereits eine Prognose, unter welchen Bedingungen am ehesten damit zu rechnen ist, dass das anfänglich wärmere Wasser schneller gefriert. Offensichtlich ist dies der Fall, wenn die Wasserproben Anfangstemperaturen von über 90 bzw. zwischen ca. 50 und 60 °C aufweisen, weil hierbei eine optimale Kombination von einem geringen zeitlichen Vorsprung für die kühlere Probe und einem möglichst großen Verdunstungsverlust bei der wärmeren Probe gegeben ist. Auf Basis der gemessenen Abkühlungs- und Verdunstungskurven sowie der in /wasser_eis-wachstum.shtml abgeleiteten Beziehungen und Wärmeübergangsdaten wurden die für ein vollständiges Gefrieren erforderlichen Zeiten von großflächigen Wasserbecken für Anfangstemperaturen von 92,5, 50, 20, 10 und 0°C bei Außentemperaturen von -4, -8, -12, -16 und -20°C für Wassertiefen von 2 bis 30 cm berechnet. Dabei benötigten die 50°C warmen Wasserproben stets die längste Zeit, um vollständig zu gefrieren. Es zeigte sich außerdem, dass mit zunehmender Wassertiefe und zunehmender Annäherung der Außentemperatur an den Gefrierpunkt der Mpemba-Effekt immer deutlicher zutage tritt. Bei 30 cm Wassertiefe gefriert bei allen zugrundegelegten Umgebungstemperaturen von allen Wasserproben, einschließlich der anfangs bereits 0°C kalten Probe, das anfangs 92,5°C heiße Wasser am schnellsten. Bei dieser Wassertiefe und -4°C Umgebungstemperatur benötigt selbst die 50°C-Probe weniger Zeit als die 0°C-Probe. Die Ergebnisse zeigen, dass sich der Mpemba-Effekt allein mit der bei heißerem Wasser erheblich stärkeren Verdunstung für einen weiten Bereich unterschiedlicher Versuchsbedingungen mühelos erklären lässt. Eine pauschale Aussage wie "Heißes Wasser gefriert schneller als eine gleiche Menge kaltes Wasser" ist jedoch definitiv falsch. Die richtige Antwort auf die betreffende Frage muss vielmehr lauten: "Je nachdem ..." Bei hinreichend nahe am Gefrierpunkt liegenden Umgebungstemperaturen und dementsprechend langen Abkühlzeiten ist übrigens zu erwarten, dass bei geeigneten Temperaturen beider Wasserproben bereits der Beginn der Eisbildung bei der anfangs wärmeren Probe zuerst eintritt. Hierzu wurden bisher jedoch noch keine Berechnungen vorgenommen. Da bei anderen Flüssigkeiten unter dementsprechenden Bedingungen ebenfalls erhebliche Verdunstungsverluste auftreten werden, ist mit einiger Sicherheit anzunehmen, dass der Mpemba-Effekt keineswegs auf Wasser beschränkt ist, sondern vermutlich bei den allermeisten Flüssigkeiten beobachtet werden kann. 2.2 Unterkühlung / Kristallkeimbildung Einige Autoren diskutieren eine unterschiedliche Unterkühlbarkeit von heißem und kaltem Wasser /2,5,6/ bzw. Unterschiede bei der Bildung von Kristallkeimen /1/ als mögliche Ursache für den Mpemba-Effekt. Da eine Unterkühlung ausschließlich als Folge eines Fehlens, nicht jedoch als Folge einer lediglich geringen Anzahl von Kristallkeimen auftritt, werden im Folgenden beide Punkte gemeinsam behandelt. In der Tat ist es möglich, Flüssigkeiten erheblich unter ihren Schmelzpunkt (=Gefrierpunkt) abzukühlen, ohne dass eine Kristallisation eintritt. Dies gelingt jedoch normalerweise nur unter besonderen Bedingungen (staubfreie Umgebung, sehr saubere Gefäße), da der Kontakt mit einem einzigen Kristallkeim bereits ausreicht, um den Vorgang der Unterkühlung zu verhindern bzw. zu beenden. Vorausgesetzt, die anfangs kühlere Wasserprobe neigt in hinreichend geringerem Maße zur Unterkühlung als die anfangs wärmere, dann kann dies ohne Weiteres dazu führen, dass selbst eine mehrfache Menge heißen Wassers noch rascher gefriert als die einfache Menge kalten Wassers. Erhebliche Unterkühlungseffekte treten bei Wasser unter Alltagsbedingungen jedoch so gut wie nie in nennenswertem Maße auf (z.B. in Form unterkühlter Teiche oder Pfützen oder von Wasser, das einfach nicht zu Eiswürfeln gefrieren mag) und scheiden daher als Ursache für Alltagserfahrungen in aller Regel aus. Laborexperimente dagegen lassen sich durchaus anhand von Unterkühlungseffekten erklären, sofern diese nicht (z.B. aus einem gemessenen Temperaturverlauf) auszuschließen sind. 2.3 Gelöste Gase Bezüglich der normalerweise in Wasser gelösten Gase (vor Allem Luftbestandteile) wird deren möglicher Einfluss auf den Gefrierpunkt, die Wärmekapazität, Konvektionsströmungen und die Wärmeleitfähigkeit erwähnt /5/, jedoch vom betr. Autoren nicht weiter untersucht. Eine Gefrierpunktserniedrigung durch im Wasser gelöste Gase scheidet als nennenswerte Einflussgröße aus. Unter normalen Bedingungen ist die Konzentration der im Wasser gelösten Gase so gering, dass die durch sie verursachte Gefrierpunkterniedrigung vernachlässigt werden kann. Sie beträgt für bei 0°C und Normaldruck mit Luft gesättigtes Wasser etwa 0,0024°C. Da Konvektionsströmungen durch Dichteunterschiede unterschiedlich temperierter Flüssigkeitsbereiche verursacht werden und der Einfluss der unter Alltagsbedingungen in Wasser gelösten Gasmengen auf die Dichte äußerst gering ist, scheidet dieser Punkt ebenfalls als Erklärung aus. Auch der Einfluss gelöster Gase auf Wärmekapazität und Wärmeleitfähigkeit ist so gering, dass er ruhigen Gewissens vernachlässigt werden kann. Anders verhält es sich mit dem, zumindest in der verwendeten Literatur überhaupt nicht erwähnten Einfluss der Gasbläschen, die beim Gefrieren des Wassers abgeschieden und im Eis eingeschlossen werden. Diese vergrößern das Volumen des Eises und verringern in ungefähr gleichem Maße seine Dichte und Wärmeleitfähigkeit. Während sich die Änderungen der Dichte und Wärmeleitfähigkeit bei der Berechnung der für das vollständige Gefrieren erforderlichen Zeit gegenseitig aufheben, geht die Volumenvergrößerung in Form einer entsprechend größeren Eis-Schichtdicke am Ende des Gefriervorgangs in die Berechnung ein. Unter günstigsten bei Normalbedingungen denkbaren Voraussetzungen (Vergleich gasfreies Wasser mit Wasser, das bei 0°C und Normaldruck mit Luft gesättigt ist, Volumen der eingeschlossenen Gasbläschen für Normaldruck berechnet) ist das Volumen des Eises aus der luftgesättigten Probe um knapp 3% größer als das des Eises aus der luftfreien Probe. Dieser Effekt ist vermutlich zu gering, um für sich allein den Mpemba-Effekt hervorzurufen, kann jedoch unter vielen Umständen einen nicht ganz unerheblichen Beitrag dazu leisten. 2.4 Sonstiges Neben den vorab aufgeführten Erklärungsversuchen werden noch einige weitere Theorien und Einflussgrößen diskutiert bzw. erwähnt. Bei Kenntnis der betreffenden physikalischen Gegebenheiten erweisen sich diese jedoch entweder als vernachlässigbar oder es handelt sich um Vorstellungen, die nicht oder nur teilweise der physikalischen Realität entsprechen. In diesem Zusammenhang scheint eine kurze Erläuterung des Zusammenhangs zwischen Temperatur und Molekülbewegung sinnvoll: Die Temperatur eines Stoffes steht in einem direkten Zusammenhang mit seinem Energiegehalt bzw. dem mittleren Energiegehalt seiner Moleküle. Diese tauschen ständig Energie untereinander aus und es stellt sich (sehr rasch) eine durch statistische Gesetzmäßigkeiten gegebene (ungleiche) Verteilung der Energie auf die einzelnen Moleküle ein. Diese Energieverteilung stellt sich nach jeder Störung (z.B. Entweichen der energiereichsten Moleküle bei Verdunstung) stets wieder aufs Neue ein. Mit anderen Worten: In mehreren Wasserproben mit der gleichen Temperatur ist die Energieverteilung auf die einzelnen Moleküle identisch, egal auf welche Weise (Abkühlen von wärmerem Wasser durch Wärmeübergang oder Verdunstung, Kondensation von Wasserdampf oder Aufheizen von kälterem Wasser) die einzelnen Wasserproben ihre (gleichen) Temperaturen erreicht haben. 2.5 Versuche mit geschlossenen Behältern Versuche unter Alltagsbedingungen werden von zwei Autoren beschrieben /7,11/. Die Versuche wurden mit relativ geringen Wassermengen in geschlossenen Behältern durchgeführt, wobei aus /11/ nicht mit Sicherheit hervorgeht, dass tatsächlich mit geschlossenen Behältern gearbeitet wurde. Erwartungsgemäß wurde der Mpemba-Effekt in keinem der beiden Fälle beobachtet. Ein weiterer Versuch wurde vom Autoren der vorliegenden Arbeit selbst durchgeführt. In ein und demselben, nahezu luftdicht geschlossenen Behälter wurden unter sonst gleichen Bedingungen jeweils 250 g Wasser mit einer Anfangstemperatur von >82°C bzw. von >14°C in ein Tiefgefrierfach bei -20°C verbracht und bis zum vollständigen Gefrieren der gesamten Wassermenge dort belassen. Da nach dem Einwiegen der Wasserprobe der Behälter zunächst verschlossen und in das Gefrierfach verbracht und anschließend noch so lange gewartet werden musste, bis die im Deckel integrierten Temperaturfühler die Wassertemperatur korrekt anzeigten, vergingen von der Einwaage bis zum ersten Vorliegen verlässlicher Temperaturmesswerte jeweils ca. 1 bis 2 Minuten. Als Versuchsbeginn wurde demzufolge der Zeitpunkt definiert, zu dem der erste verlässliche Temperaturwert vorlag. Bei dem Behälter handelte es sich um eine insgesamt 55 mm hohe rechteckige Lebensmittelverpackung aus dünnem, durchsichtigem Polypropylen mit abgerundeten Ecken. Der Füllstand mit 250 g Wasser betrug bei 14°C 32 mm. Der Wärmeaustausch über den Behälterboden wurde mittels einer untergelegten ca. 1 cm dicken Isolierschicht aus feinporigem PU-Schaum erheblich eingeschränkt. Mit Hilfe von 2 Temperaturfühlern mit vernachlässigbarer Masse wurden die Temperaturverläufe direkt über dem Behälterboden bzw. dicht unter der Wasseroberfläche aufgenommen. Die Zeitpunkte für Beginn und Ende der Eisbildung wurden jeweils aus dem aus beiden Messwerten gemittelten Temperaturverlauf ermittelt. Das Ergebnis ist in der nachfolgenden Tabelle dargestellt:
==================================
Ereignis Zeit/Dauer(h:min)
bzw. Vers.1 Vers.2
Resultat Anfangstemperatur
ca.14°C >82°C
==================================
Versuchsbeginn 0:00 0:00
Beginn Eisbildung 0:45 2:03
Ende Eisbildung 7:20 8:26
----------------------------------
Dauer Eisbildung 6:35 6:23
==================================
Auch bei diesem Versuch gefror, wie zu erwarten war, das anfangs kalte Wasser eindeutig vor dem anfangs heißeren Wasser. Nach den Versuchen wurde der jeweilige Eisblock aus dem Behälter entfernt und in Augenschein genommen. In beiden Fällen war das Eis sowohl von der Oberfläche als auch von den Seiten her in Richtung auf die Mitte des Behälterbodens gewachsen. Da sich zunächst so lange klares Eis ohne Lufteinschlüsse bildet, bis die verbliebene Flüssigphase mit zumindest einem Luftbestandteil gesättigt ist, konnte aus der Größe des durch Lufteinschlüsse getrübten Bereichs ein erheblicher Unterschied in den Anfangskonzentrationen der gelösten Gase bei beiden Versuchen abgeleitet werden. Unter der Annahme, dass die Luftgehalte für Versuch-1 und -2 bei ca. 70% bzw. ca. 20% der Löslichkeitsgrenze bei 0°C lagen, wurde für Versuch-2 eine um 8 Minuten kürzere Eisbildungsdauer gegenüber Versuch-1 berechnet. Dies steht, angesichts der für die zugrundegelegten Annahmen und experimentellen Ergebnisse, insbesondere der Gefrierdauer, anzusetzenden Toleranzen, in guter Übereinstimmung mit den beobachteten 12 Minuten Differenz. Ein Vergleich der bei beiden Versuchen gemessenen Temperaturverläufe an den 2 Messpunkten zeigte im Übrigen bei jeweils gleicher mittlerer Temperatur keinen nennenswerten Unterschied im Vehalten der anfangs heißen und der anfangs kalten Probe, was auf das Vorliegen weitgehend ähnlicher Strömungsverhältnisse in beiden Proben schließen lässt. 3. Praktische Nutzung des Mpemba-Effekts Eine praktische oder technische Nutzung des Mpemba-Effekts steht zwar jedem frei, ist nach den vorliegenden Erkenntnissen jedoch unsinnig, was im Folgenden am Beispiel Eiscremebereitung demonstriert werden soll. Ziel einer Eiscremebereitung ist logischerweise die Herstellung einer bestimmten bzw. der gewünschten Menge Eiscreme. Eine "Nutzung" des Mpemba-Effekts wäre in diesem Fall (Unterkühlungseffekte nicht zu erwarten) nur in einem offenen Behälter möglich. Wegen der Verdunstung eines Teils der eingesetzten Milch sind nun zwei Szenarien denkbar:
Auch im (eher hypothetischen) Fall einer länger dauernden Unterkühlung der Eisbereitungsmasse wäre es wenig hilfreich, den Gefrierprozess durch Verwendung heißer Milch beschleunigen zu wollen. Die diesbezüglich geeignete technische Maßnahme wäre vielmehr ein gezieltes Einbringen einer geringen Menge einer festen "Verunreinigung" (z.B. Zucker o.Ä.), um das Kristallisieren des Eises einzuleiten. Insofern kann der Mpemba-Effekt für diejenigen, die an seine Nützlichkeit glauben, eine probate Methode darstellen, sich kostenpflichtig selbst zu veräppeln, ohne dies selber wahrzunehmen. Die Nutzung des Mpemba-Effekts im Rahmen von Showveranstaltungen ist differenziert zu betrachten. Der Veranstalter verdient daran, die Zuschauer werden immerhin unterhalten. Sofern dabei eine korrekte Erklärung stattfindet, könnten letztere dabei sogar etwas dazulernen. Letzteres ist angesichts des z.T. groben Unfugs, der zum Thema kursiert, derzeit jedoch kaum zu erwarten. 4. Zusammenfassung Aus den verwendeten Quellen sowie eigenen Berechnungen und unter Alltagsbedingungen vorgenommenen experimentellen Untersuchungen geht hervor: 4.1. Berechnungen zufolge tritt bei Verwendung offener Gefäße und gleicher Anfangsmengen von Wasser der Mpemba-Effekt innerhalb eines weiten Bereichs von Versuchsbedingungen auf. Hauptursache hierfür ist die überproportional mit der Anfangstemperatur zunehmende verdunstende Wassermenge. In weit geringerem Maße wirkt sich zusätzlich der im Wasser bei höherer Anfangstemperatur normalerweise geringere Gasgehalt in der Weise aus, dass das resultierende Eisvolumen und damit die für den Wärmetransport maßgebliche Schichtdicke mit dem Volumen der enstehenden Lufteinschlüsse abnimmt. Das Auftreten des Mpemba-Effekts wird durch eine große Wassertiefe (bei Ausschluss erheblicher Wärmeabfuhr durch die Gefäßwand) und eine nur wenig unter dem Gefrierpunkt liegende Umgebungstemperatur begünstigt. 4.2. Bei Verwendung geschlossener Gefäße oder beim Ausgleich der verdunsteten Wassermenge durch eine entsprechend erhöhte Ausgangsmenge des heißen Wassers kann der Mpemba-Effekt nur dann eintreten, wenn besondere Versuchsbedingungen eine erhebliche Unterkühlung der Wasserproben zulassen, was unter Alltagsbedingungen in aller Regel nicht der Fall ist. 4.3. Der Mpemba-Effekt ist vermutlich nicht auf Wasser beschränkt. Ob er auftritt und unter welchen Bedingungen, wird hauptsächlich durch die kalorischen Daten einer Substanz bzw. deren Verhältnisse zueinander bestimmt. Wer sich nicht scheut, offene Behälter mit heißem Benzol o.Ä. in sein Gefrierfach zu stellen, kann ja entsprechende Versuche anstellen. 4.4. Eine praktische Anwendung des Mpemba-Effekts ist, abgesehen von seiner (gewinnträchtigen) Wirksamkeit als Showeffekt, unsinnig. 5. Quellenverzeichnis /1a/ (mehrere Quellen zusammengefasst, da identisch im Wortlaut): mpemba-effekt.lexikona.de/... wissenglobal.de/... enzyklopda.de/... /1b/ (mit zusätzlichem kurzem Statement): lextoday.de/... lexikon.freenet.de/... physik.naturtoday.de/... /2/ 3sat.de/nano/... /3/ zeit.de/stimmts/... (DIE ZEIT 27/1997) /4/ ammenmaerchen.de /5/ desy.de/... /6/ lsbu.ac.uk/water/ /7/ ingeniordebat.dk/... /8/ Christa Pöppelmann: 1000 Irrtümer der allgemeinen Bildung, Compact Verlag, 2005 /9/ Felix R. Paturi: Die letzten Rätsel der Wissenschaft, Eichborn, 2005 /10/ ask.yahoo.com/... /11/ itotd.com/... /12/ Meyer/Schiffner: Technische Thermodynamik, VEB Fachbuchverlag, Leipzig 1989 |
|
Gästebuch Impressum Datenschutz Disclaimer Zitationsregeln Layout |